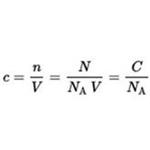Odpowiedzi na często zadawane pytania - miareczkowanie
Miareczkowanie to technika analityczna umożliwiająca oznaczenie ilościowe określonej substancji (analitu) rozpuszczonej w próbce. Opiera się ona na obserwacji kompletnej reakcji pomiędzy analitem a titrantem o znanym stężeniu, dodawanym do próbki:
Analit + Odczynnik (Titrant) → Produkty reakcji
Znajdź odpowiedzi na pytania związane z miareczkowaniem!
Co to jest miareczkowanie? Jaka jest definicja miareczkowania?
Miareczkowanie to technika analityczna umożliwiająca oznaczenie ilościowe określonej substancji (analitu) rozpuszczonej w próbce. Opiera się ona na obserwacji kompletnej reakcji pomiędzy analitem a titrantem o znanym stężeniu, dodawanym do próbki:
Analit + Odczynnik (Titrant) = Produkty reakcji
Dobrze znanym przykładem jest miareczkowanie kwasu octowego (CH3COOH) w occie za pomocą wodorotlenku sodu (NaOH).
CH3COOH + NaOH → CH3COO- + Na+ + H2O
Titrant podawany jest do momentu zakończenia reakcji. Aby możliwe było oznaczanie, zakończenie reakcji miareczkowania musi być łatwe do zaobserwowania. Oznacza to, że reakcja musi być monitorowana (oznaczana) odpowiednimi technikami, np. potencjometrii (pomiaru potencjału za pomocą czujnika) lub wskaźnikami barwnymi. Pomiar objętości podanego titranta umożliwia obliczenie składu analitu na podstawie stechiometrii reakcji chemicznej. Reakcja związana z miareczkowaniem musi przebiec szybko i w całości, być jednoznaczna i możliwa do zaobserwowania.
Co to jest krzywa miareczkowania?
Krzywe miareczkowania ilustrują zmiany jakościowe podczas miareczkowania. Pozwalają na szybką ocenę metody miareczkowania. Wyróżnia się krzywe miareczkowania liniowe i logarytmiczne.
Krzywa miareczkowania zależy od dwóch zmiennych:
Objętość titranta jest zmienną niezależną. Sygnał roztworu, np. wartość pH w miareczkowaniu alkacymetrycznym, jest zmienną zależną powiązaną ze składem stosowanych dwóch roztworów.
Wykresy miareczkowania mogą przyjąć 4 rożne postaci i powinny zostać poddane analizie zgodnie z odpowiednimi algorytmami oceny. Wspomniane 4 postaci to: krzywa symetryczna, krzywa asymetryczna, krzywa skokowa i krzywa odcinkowa
Co to jest miareczkowanie kwasów/zasad?
Miareczkowanie alkacymetryczne to analiza ilościowa wykorzystywana w celu określenia stężenia nieznanego roztworu kwasu lub zasady poprzez dodawanie odmierzonych objętości znanego titranta kwasowego lub zasadowego zobojętniającego analit.
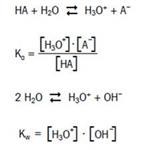
Podczas miareczkowania kwasu HA w mocnej zasadzie (np. NaOH) zachodzą dwa procesy zgodne ze schematami reakcji przedstawionymi obok.
Reakcje zobojętniania przebiegają niezwykle szybko i prowadzą do szybkiego osiągnięcia stanu równowagi chemicznej. Dlatego reakcje zobojętniania w roztworach wodnych są idealne do miareczkowania. Jeżeli wykorzystane roztwory nie są nazbyt rozcieńczone, kształt krzywych miareczkowania zależy od stałej dysocjacji Ka.
Jak obliczyć molarność / stężenie molowe / stosować wzór stężenia molowego
Wielkość stężenia substancji w roztworze X (symbol c(X)) to ilość substancji n podzielona przez objętość V roztworu.
N oznacza liczbę cząsteczek obecnych w objętości V (w litrach), stosunek N/V to stężenie C, natomiast NA to stała Avogadra wynosząca ok. 6,022×1023 mol−1.
Jednostki zwyczajowo stosowane w analizie to mol/l i mmol/l.
Czym różni się miareczkowanie do punktu końcowego od miareczkowania do punktu równoważnikowego?
Tryb miareczkowania do punktu końcowego (EP):
Jest to klasyczna procedura miareczkowania: titrant jest podawany do momentu wizualnego zaobserwowania końca reakcji, np. zmiany koloru wskaźnika. W przypadku automatycznego titratora próbka jest miareczkowana aż do osiągnięcia ustalonej wstępnie wartości, np. pH = 8,2.
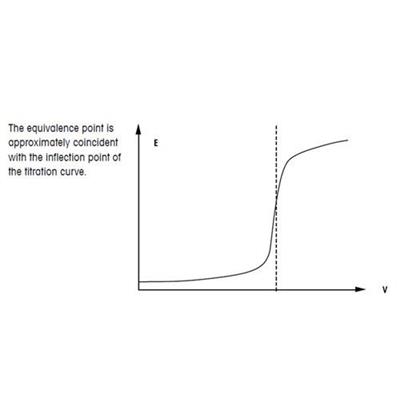
Tryb miareczkowania do punktu równoważnikowego (EQP):
Punkt równoważnikowy jest punktem, w którym analit i odczynnik osiągają dokładnie takie same ilości. W większości przypadków jest to równoważne osiągnięciu punktu przegięcia na krzywej miareczkowania, np. krzywej otrzymanej w wyniku miareczkowania alkacymetrycznego. Punkt przegięcia krzywej jest definiowany przez powiązanie wartości pH lub potencjału (mV) oraz zużycia titranta (ml). Punkt równoważnikowy jest obliczany na podstawie zużycia titranta o znanym stężeniu. Iloczyn stężenia i zużycia titranta daje ilość substancji, która weszła w reakcję z próbką. W przypadku titratora automatycznego punkty pomiarowe są przetwarzane według określonych procedur matematycznych, które prowadzą do obliczenia krzywej miareczkowania. Następnie na podstawie tej krzywej jest obliczany punkt równoważnikowy.
Co to jest miareczkowanie odwrotne?
Do miareczkowania odwrotnego wykorzystuje się dwa odczynniki – jeden wchodzący w reakcję z próbką źródłową (A) oraz kolejny, wchodzący w reakcję z pierwszym odczynnikiem (B).
Najpierw należy dodać do próbki precyzyjnie odmierzony nadmiar odczynnika A. Po zakończeniu reakcji, pozostały nadmiar odczynnika A jest miareczkowany z odczynnikiem B. Różnica pomiędzy dodaną ilością pierwszego i drugiego odczynnika pozwala nam oznaczyć ilość analitu. Miareczkowanie odwrotne stosuje się głównie w przypadkach, gdy reakcja miareczkowania bezpośredniego jest zbyt powolna lub bezpośrednie wskazanie punktu ekwiwalencji jest niesatysfakcjonujące. Na przykład w przypadku określania zawartości wapnia z wykorzystaniem odczynników EDTA (A) i ZnSO4 (B)
Jakie są zalety miareczkowania?
- Klasyczna, sprawdzona technika analityczna
- Szybkość
- Wysoka dokładność i precyzja
- Wysoki stopień automatyzacji
- Dobry stosunek ceny do wydajności w porównaniu z bardziej zaawansowanymi technikami
- Możliwość stosowania przez operatorów o różnym doświadczeniu
- Nie wymaga specjalistycznej wiedzy z zakresu chemii
Jakie rodzaje reakcji chemicznych są wykorzystywane w miareczkowaniu?
W miareczkowaniu wykorzystywane jest kilka rodzajów reakcji:
- Reakcje kwas/zasada:
Przykłady: Zawartość kwasów w winie, mleku. Zawartość kwasów w keczupie. Zawartość kwasów nieorganicznych, np. siarkowego.
- Reakcje strącania:
Przykłady: Zawartość soli w chipsach, keczupie i potrawach; Zawartość srebra w monetach; Zawartość siarczanów w wodzie mineralnej; Zawartość siarczanów w kąpieli galwanicznejReakcje redoks:Przykłady: Zawartość miedzi, chromu i niklu w kąpieli galwanicznejReakcje kompleksometryczne:Przykłady: Całkowita twardość wody (Mg i Ca); Zawartość wapnia w mleku i serze; Analiza składu cementuReakcje strącania koloidalnego:Prz
ykłady: Zawartość surfaktantu anionowego w detergentach; Zawartość surfaktantu anionowego w proszkach do prania; Zawartość surfaktantu anionowego w płynnych środkach czyszczących.
Jakie metody oznaczania stosowane są w miareczkowaniu?
Miareczkowanie można klasyfikować pod względem zasady oznaczania i występującej reakcji chemicznej:
Potencjometria:
Bezpośredni pomiar zmian napięcia elektrycznego generowanego przez ogniwo uzyskane przez zastosowanie elektrod nazywane jest nazywany jest potencjometrią, natomiast miareczkowanie wykonywane z zastosowaniem tej metody nazywamy miareczkowaniem potencjometrycznym.
Powstające napięcie U w miarę możliwości powinno być zmierzone w warunkach bezprądowych i z wykorzystaniem wzmacniacza o wysokiej impendancji z uwagi na poniższe:
Podstawą potencjometrii jest równanie Nernsta stosowane do czujników w stanie równowagi chemicznej i elektrycznej. Nadmierny przepływ prądu pomiędzy powierzchniami granicznymi fazy zakłóciłoby tę równowagę.
Kolejną przyczyną stosowania urządzeń pomiarowych z wysoką impendancją jest specyficzna budowa elektrod pH i jonoselektywnych. Obwód pomiarowy obejmuje membranę jonoselektywną, której rezystancja z łatwością osiąga wartości w przedziale 100–1000 MΩ. Jeżeli błąd pomiaru wskutek wystąpienia dzielnika napięcia ma przyjąć wartości poniżej 0,1%, wejściowa impendancja instrumentu pomiarowego powinna być co najmniej 1000-krotnie większa. Wynika to z powyższego równania. W przypadku czujników bardzo wysokiej rezystancji konieczne jest stosowanie wzmacniaczy sygnałów z impendancją wejściową o wartości 1012 Ω.
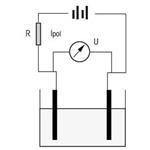
Woltamperometria:
Ta technika pomiarowa obejmuje pomiar różnicy potencjału pomiędzy dwiema elektrodami metalowymi spolaryzowanymi przez prąd o małym natężeniu. Podobnie jak w przypadku potencjometrii, krzywa miareczkowania woltoamperometrycznego jest krzywą różnicy potencjałów.
Potrzebne są następujące urządzenia:
Stabilizowane źródło zasilania jest źródłem prądu. Wartość rezystancji R włączonej do obwodu musi być wybrana tak, aby prąd Ipol mógł przyjmować wartości w przedziale 0,1–20 μA. Różnica potencjałów U występująca pomiędzy elektrodami może być zmierzona tak samo jak w przypadku potencjometrii. Jednym z głównych zastosowań oznaczania woltoamperometrią jest
Fotometria:
Podstawą oznaczania fotometrycznego jest spadek natężenia fali świetlnej przepływającej przez roztwór przy określonej długości fali. Transmisja (przepuszczanie) jest podstawową zmienną fotometryczną.
T: Transmisja
I0: Chwilowe natężenie światła
I: Natężenie światła po przejściu
W przypadku pełnej absorbancji światła I = 0, a zatem T = 0. W przypadku całkowitego braku pochłaniania światła
I = I0, a T = 1 (lub %T = 100%).
Oznaczenia z wykorzystaniem fotometrii są często wykonywane z zastosowaniem pomiaru zmiennej absorbancji. Zależność pomiędzy transmisją i absorbancją opisuje prawo Beera-Lamberta-Bouguera:
A = − log T = A = ε · b · c
A: Absorbancja (pochłanianie)
ε: Stała proporcjonalności
c: Stężenie substancji w roztworze
d: Grubość warstwy absorbującej (droga, jaką pokonuje promieniowanie, przechodząc przez roztwór)
Z powyższego związku można zauważyć, że pomiędzy pochłanianiem A i stężeniem c występuje związek liniowy.
W przypadku miareczkowania czujniki fotoelektryczne mają szereg zalet w porównaniu z czujnikami potencjometrycznymi:
- są łatwiejsze do zastosowania (brak konieczności uzupełniania roztworu elektrolitu lub zapychania się obwodu)
- mają dłuższą żywotność (są praktycznie bezawaryjne)
- można je stosować do wszystkich klasycznych miareczkowań do zmiany koloru (bez zmiany tradycyjnych procedur i standardów).
Oznaczanie fotometryczne znajduje swoje zastosowanie w szeregu reakcji analitycznych, takich jak:
- miareczkowanie alkacymetryczne (z roztworach wodnych i bezwodne)
- kompleksometria
- redoksymetria
- miareczkowanie strąceniowe
- miareczkowanie turbimetryczne
W miareczkowaniu fotometrycznym należy wybrać taką długość fali, która pozwala na uzyskanie możliwie największej różnicy transmisji przed i za punktem równoważnikowym. W zakresie fali widocznych ludzkim okiem długości tych fal przyjmują wartości w zakresie od 500 do 700 nm.
Przykłady użycia: Reakcje kompleksometryczne i turbidymetryczne.
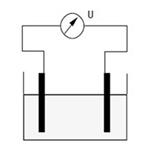
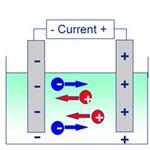
Przewodność:
Przewodność opisuje zdolność roztworu do przewodzenia prądu elektrycznego. Jednostką przewodności jest µS/cm (mikrosiemens/centymetr) lub mS/cm (milisiemens/centymetr). Wysokie wartości wskazują na wysoką liczbę jonów. Natężenie prądu indukowanego w roztworze jest proporcjonalne do liczby jonów. Znając przewodność roztworu, można obliczyć zawartość jonów. Jeżeli znany jest rodzaj tych jonów, można wtedy obliczyć ich stężenie.
Do pomiaru przewodności podaje się napięcie pomiędzy dwoma płytkami zanurzonymi w roztworze. Płytki musza być wykonane z metalu lub z grafitu. Podczas ruchu rozpuszczonych w roztworze jonów w kierunku płytek wystąpi przepływ prądu pomiędzy płytkami.
Zasady miareczkowania konduktometrycznego
Podczas miareczkowania jony jednego typu są zastępowane przez jony innego typu. Z uwagi na to, że te dwa typy jonów różnią się pod kątem przewodnictwa, zmiany te sprawią, że w toku miareczkowania przewodność roztworu będzie podlegała zmianom. Dlatego też jeżeli dodamy roztwór jednej elektrody do drugiej, końcowa przewodność będzie zależała od tego, czy zajdzie reakcja. Jeżeli pomiędzy roztworami elektrolitów reakcja nie wystąpi, nastąpi wzrost poziomu przewodności. Punkt równoważnikowy można wyznaczyć graficznie poprzez śledzenie zmian przewodności jako funkcji objętości dodanego titranta.
Miareczkowanie termometryczne:
Miareczkowanie termometryczne: zgodnie z twierdzeniem elementarnym, każdej reakcji chemicznej towarzyszy zmiana w poziomie energii. Wspomniana zmiana jest podstawą miareczkowania termometrycznego. Podczas reakcji endotermicznych następuje absorpcja energii i obserwuje się spadek temperatury. W przypadku reakcji egzotermicznych dzieje się odwrotnie i następuje uwalnianie energii. Punkt równoważnikowy PR (ang. EQP) miareczkowania można wyznaczyć graficznie poprzez śledzenie zmian temperatury (rys. 1). W trakcie miareczkowania egzotermicznego następuje wzrost temperatury aż do osiągnięcia PR (ang. EQP). Następnie temperatura się stabilizuje, po czym następuje jej spadek. W przypadku miareczkowania endotermicznego zachodzi zjawisko odwrotne.
Jak wyjaśniono powyżej, podczas reakcji miareczkowania endotermicznego obserwuje się spadek temperatury. Temperatura stabilizuje się po osiągnięciu punktu równoważnikowego. Punkt końcowy jest wyznaczany przez obliczanie drugiej pochodnej krzywej (ocena segmentowa).
Miareczkowanie termometryczne wymaga jedynie: reakcji chemicznej z dużą zmianą w energii, precyzyjnego i szybkiego termometru oraz titratora mogącego przeprowadzić ewaluację segmentową krzywej miareczkowania.
Miareczkowanie kulometryczne
Technika miareczkowania kulometrycznego została opracowana przez Szebeledyego i Somogyego [1] w 1938 r. Wspomniana metoda różni się od miareczkowania wolumetrycznego tym, że titrant jest wytwarzany miejscowo przez elektrolizę, a następnie reaguje stechiometrycznie z oznaczaną substancją. Ilość substancji, która weszła w reakcję, jest obliczana na podstawie natężenia prądu Q, podawanego w kulombach, który przepłynął przez obwód. Jest to istotna różnica w porównaniu do miareczkowania wolumetrycznego, w którym to określa się ilość zużytego roztworu mianowanego.
W jakich branżach lub dziedzinach wykorzystuje się miareczkowanie?
Branże wykorzystujące miareczkowanie to m.in.:
- przemysł samochodowy, przemysł ceramiczny, przemysł chemiczny, przemysł węglowy, przemysł farbiarski,
- przemysł kosmetyczny
- detergenty
- przemysł elektroniczny, przemysł galwanotechniczny, przemysł energetyczny, produkcja materiałów
- wybuchowych
- przemysł spożywczy
- produkcja szkła, sektor publiczny
- służba zdrowia
- przemysł skórzany
- przemysł maszynowy
- przemysł opakowaniowy, produkcja farb, pigmentów, przemysł papierniczy i celulozowy, przemysł
- farmaceutyczny, przemysł tworzyw sztucznych, przemysł drukarski i wydawniczy
- kolejnictwo, przemysł gumowy
- kruszywa (glina, cement)
- przemysł tekstylny i tytoniowy
- woda
- zeolity
Jak można przyspieszyć dodawanie titranta (inkrementalnie vs. dynamicznie)?
Przyrostowe (inkrementalne) dodawanie roztworu oznaczonego (INC)
Titrant jest wielokrotnie (dV) dodawany w stałej objętości. Przyrostowe dodawanie roztworu oznaczonego stosuje się w miareczkowaniu niewodnym, które czasami charakteryzuje się niestabilnym sygnałem, a także w miareczkowaniu redoks i fotometrycznym, gdzie skok do punktu równoważnikowego następuje w sposób nagły. Należy zwrócić uwagę na to, że w najbardziej stromym odcinku krzywej jest relatywnie niewiele punktów pomiaru.
Dynamiczne dodawanie titranta (DYN)
Stałe pH- lub zmiany potencjału przy dodawaniu kolejnych objętości pozwala na różnicowanie przyrostu objętości w zakresie pomiędzy minimalnym i maksymalnym przyrostem objętości.
Pozwala to na przyspieszenie analizy poprzez stosowanie dużych przyrostów w płaskich regionach krzywej miareczkowania. Co więcej, uzyskuje się w ten sposób więcej punktów pomiarowych w najbardziej stromych odcinkach krzywej, co pozwala na zwiększenie dokładności analizy.
Dlaczego podczas miareczkowania do punktu równoważnikowego za pomocą titratora automatycznego uzyskuję wyniki różne od tych z miareczkowania ręcznego za pomocą wskaźnika barwnego?
Taka rozbieżność wyników jest szczególnie widoczna w przypadku miareczkowania kwasowo-zasadowego z zastosowaniem wskaźnika pH. Pierwsza przyczyna to fakt, że wskaźniki pH zmieniają kolor w pewnym zakresie pH zamiast przy stałej wartości. Punkt, w którym następuje zmiana koloru, w dużej mierze zależy od wielkości próbki i może nie pokrywać się z chemicznym punktem równoważnikowym. Może to skutkować niewielką rozbieżnością wyników, którą można w łatwy sposób usunąć poprzez mianowanie titranta metodą podobną do tej stosowanej dla próbek.
Druga przyczyna tej różnicy jest związana z wrażliwością oka ludzkiego na zmianę koloru. Gdy kolor zaczyna się zmieniać, oko ludzkie może nie dostrzegać jeszcze żadnej różnicy. Można to zademonstrować za pomocą czujnika fotometrycznego, np. fototrody DP5 METTLER TOLEDO. Czujnik wykaże wyraźną zmianę przepuszczalności optycznej na długo przed tym, jak oko ludzkie zarejestruje jakąkolwiek zmianę koloru. W przypadku typowego miareczkowania potencjometrycznego z zastosowaniem elektrody pH gwałtowna zmiana sygnału następuje natychmiast w chwili pojawienia się śladowego nadmiaru kwasu (lub zasady) i z tego względu jest lepszym wskazaniem punktu końcowego miareczkowania.
Jakiej elektrody należy używać do miareczkowania w roztworach niewodnych?
Wyróżnia się trzy główne problemy z elektrodą przy miareczkowaniu w roztworach niewodnych. Pierwszy to zastosowanie elektrolitu wodnego przy niewodnym rozpuszczalniku. Rozwiązaniem jest po prostu wymiana elektrolitu w elektrodzie. Problem drugi wiąże się z tym, że próbka jest nieprzewodząca, co skutkuje nie dość silnym obwodem elektrycznym pomiędzy półogniwem pomiarowym a referencyjnym lub częściami elektrody kombinowanej. Wynikiem jest zakłócony sygnał, zwłaszcza przy użyciu czujnika ze standardowym złączem ceramicznym w układzie odniesienia. Częściowym rozwiązaniem tego problemu jest użycie elektrody z tuleją na złączu, np. DG113. Elektroda używa jako elektrolit standardowy LiCl w roztworze etanolu, a zamiast złącza ceramicznego ma polimerową tuleję, co skutkuje większą powierzchnią styku pomiędzy częścią pomiarową a referencyjną, a tym samym zmniejszeniem zakłóceń.
Problem trzeci to nie tyle problem z samą elektrodą, co z obsługą. Aby szklana elektroda (pH) działała prawidłowo, jej membrana (bańka elektrody) musi być nawilżona. Osiąga się to poprzez kondycjonowanie elektrody w wodzie dejonizowanej. Podczas miareczkowania w roztworze niewodnym membrana ta stopniowo ulega odwodnieniu, co obniża czułość elektrody. Aby temu zapobiec bądź rozwiązać problem, elektrodę należy regularnie kondycjonować poprzez zanurzanie w wodzie.
Jak często należy mianować titrant?
Zależy to od stabilności titranta i przeprowadzonych procedur zabezpieczenia titranta przed typowymi zanieczyszczeniami, które mogłyby doprowadzić do obniżenia stężenia. Najczęściej spotykanymi przykładami takiej ochrony titranta są przechowywanie titrantów światłoczułych (np. roztworów jodu) w butelkach z ciemnego szkła, zabezpieczanie titrantów Karla Fischera przed wilgocią za pomocą sita molekularnego lub żelu krzemionkowego, jak również ochrona niektórych silnych zasad (np. wodorotlenku sodu) przed wchłanianiem dwutlenku węgla.
Co to jest titrator automatyczny?
Titratory automatyczne to urządzenia mikroprocesorowe umożliwiające automatyzację wszystkich operacji związanych z miareczkowaniem:
- Dodanie titranta
- Monitorowanie reakcji (pozyskiwanie sygnału)
- Rozpoznawanie punktu końcowego
- Przechowywanie danych
- Obliczenie
- Pamięć wyników
- Transfer danych do drukarki lub komputera/systemu zewnętrznego
Jak działa automatyczny titrator?
Titratory automatyczne kierują się określoną sekwencją operacji. Sekwencja ta jest zasadniczo taka sama dla różnych modeli i marek. Powtarzana jest kilkukrotnie aż do osiągnięcia punktu końcowego lub równoważnikowego miareczkowania (cykl miareczkowania). Cykl miareczkowania to 4 główne etapy:
- Dodanie titranta
- Reakcja miareczkowania
- Pozyskiwanie sygnału
- Ocena
Każdy etap cechuje się określonymi parametrami (np. wielkość przyrostu), które należy zdefiniować zgodnie z konkretnym zastosowaniem. Bardziej złożone zastosowania wymagają więcej etapów, np. podawania dodatkowego odczynnika dla miareczkowania wstecznego, rozcieńczania, regulacji wartości pH. Etapy te i odpowiadające im parametry zawarte są w metodzie miareczkowania.
Jaka jest historia rozwoju automatycznych titratorów?
Sposób klasyczny:
Miareczkowanie jest klasyczną, szeroko rozpowszechnioną techniką analityczną. Początkowo przeprowadzana była poprzez podawanie titranta za pomocą stopniowanego szklanego cylindra (biurety). Podawanie titranta regulowane było ręcznie za pomocą zaworu. Zmiana barwy oznaczała zakończenie reakcji miareczkowania (punkt końcowy). Początkowo przeprowadzano tylko te reakcje, które skutkowały wyraźną zmianą barwy. Z czasem odczynniki zaczęły być sztucznie barwione za pomocą wskaźnika. Osiągana precyzja zależała głównie od umiejętności chemika, przede wszystkim jego postrzegania barw.
Sposób nowoczesny:
Miareczkowanie znacznie się rozwinęło: ręczne i (później) mechaniczne biurety tłokowe umożliwiają powtarzalne i dokładne podawanie titranta. Elektrody do pomiaru potencjału zastąpiły barwne wskaźniki, zwiększając precyzję i trafność pomiarów. Wykres potencjału w funkcji objętości titranta umożliwia dokładniejsze śledzenie reakcji niż zmiana barwy w punkcie końcowym. Dzięki mikroprocesorom miareczkowanie może być sterowane i oceniane automatycznie. Jest to znaczny krok w stronę całkowitej automatyzacji.
Dziś i jutro:
Technika miareczkowania wciąż się rozwija. Nowoczesne titratory automatyczne umożliwiają programowanie całych sekwencji analizy i uzyskiwanie maksymalnej elastyczności w projektowaniu nowych metod. Dla każdego zastosowania można zdefiniować określoną metodę, łącząc proste funkcje, takie jak dozowanie, mieszanie, miareczkowanie czy obliczanie, w danej kolejności. Akcesoria (zmieniacze próbek, pompy) redukują i upraszczają pracę wymaganą w laboratoriach. Nowym trendem jest połączenie z komputerami i laboratoryjnymi systemami zarządzania informacjami (LIMS).
Aby uzyskać więcej informacji odwiedź stronę METTLER TOLEDO.
- Autor:
- METTLER TOLEDO
- Dodał:
- Mettler-Toledo Sp. z o. o.
Czytaj także
-

Podstawy miareczkowania
Miareczkowanie to technika analityczna umożliwiająca oznaczenie ilościowe określonej substancji rozpuszczonej w próbce. Z tego podręcznika dowiesz...
-

Kluczowa rola wycinarek laserowych w obróbce metali
Wycinarki laserowe zrewolucjonizowały przemysł obróbki metali, oferując niezwykłą precyzję i efektywność. Dowiedz się, dlaczego są one...
-

-

-
-
-

-